HPLC Labor
Unser HPLC Labor (und auch UPLC Labor) ist Teil unserer modernen Infrastruktur, in dem ein unabhängiges CRO Team Lösungen für Pharma und Chemie anbietet.
In unserem Labor arbeitet ein sehr erfahrenes Team von Chemikern, Ingenieuren und Labormitarbeitern, die langjährige F&E, Analytik und Projektmanagement Berufserfahrung in globalen pharmazeutischen Unternehmen vorweisen können. Mehr als die Hälfte der Teammitglieder sind promovierte Wissenschaftler.
HPLC & UPLC wird in unserem Labor überwiegend für die Gehalts- und Reinheitsbestimmungen von pharmazeutischen Produkten verwendet.
Was ist HPLC? - Grundprinzipien
HPLC & UPLC sind beides flüssig-chromatographische Trennverfahren (LC = Liquid Chromatography). Das bedeutet, das eine Flüssigkeit (=mobile Phase oder Eluent) über eine Trennsäule (=stationäre Phase) gepumpt wird. Injiziert man in ein solches chromatographische System ein gelöstes Substanzgemisch, lässt sich dieses durch Wechselwirkungen mit der stationären Phase in seine einzelnen Komponenten auftrennen.
Die aufgetrennten Komponenten oder Einzelsubstanzen erreichen nach dem Durchwandern der Trennsäule einen Detektor, der ein der Komponentenmenge proportionales Signal graphisch als sogenanntes Chromatogramm ausgibt. Im Idealfall repräsentiert jeder Peak eines Chromatogramms eine Komponente des Substanzgemischs.
Sowohl HPLC als auch UPLC lassen sich zur Identifizierung und Quantifizierung von Substanzen oder aufgetrennten Komponenten eines Substanzgemisches verwenden. Im Falle der GPC (Gel Permeation Chromatography) oder auch SEC (Size Exclusion Chromatography) genannt, einer speziellen Unterart der Liquid Chromatography, ist durch Auftrennung eines Substanzgemisches nach unterschiedlicher Grösse der Einzelkomponenten auch die Bestimmung der Molekulargewichtsverteilung möglich.
Die instrumentelle Grundausstattung von HPLC und UPLC sind prinzipiell gleich. Beide Varianten der Flüssigkeitschromatographie bestehen instrumentell im Prinzip aus:
- Eluentenreservoir
- Pumpe (isokratisch/Gradient)
- Probeaufgabe (Injektor)
- Säule
- Detektor
- Datenaufnahme- und Steuersoftware
Wie unterscheiden sich HPLC und UPLC?
Beim Durchpumpen der mobilen Phase über eine stationäre Phase entstehen im chromatographischen Messsystem relativ hohe Drücke. So wurde die HPLC Technik in ihren Anfangszeiten auch als High Pressure Liquid Chromatography bezeichnet.
Die HPLC (High Performance Liquid Chromatography) arbeitet typischerweise mit Säulendrücken von bis zu 400 bar (ungefähr 6.000 psi), während die UPLC (Ultra Performance Liquid Chromatography) bei höheren Drücken um die 1000 bar (15.000 psi) arbeiten kann.
Die höheren Drücke in der UPLC im Vergleich zur HPLC rühren vom Einsatz kleinerer Partikel des Säulenmaterials her. Diese Entwicklung zu immer kleineren partikulären Packungsmaterialien für die Trennsäulen leitete den Wechsel von HPLC zu UPLC ein. Während in der klassischen HPLC Partikelgrößen von drei bis fünf Mikrometer verwendet werden, sind UPLC-Säulen mit Partikeln von oft nur noch 1,5 µm Größe gepackt.
Durch die Miniaturisierung der Partikel in der UPLC wurde die Leistungsfähigkeit der HPLC Technik um ein Vielfaches gesteigert, da sich Analysenzeiten drastisch verkürzen liessen, die Trenneffizienzen deutlich gesteigert wurden und somit höhere Probendurchsätze mit kleineren Probemengen und weniger Eluentenverbrauch realisiert werden konnten. Zudem erreicht man bei konzentrationsabhängeigen Detektoren auch eine Erniedrigung der Nachweisgrenzen von Substanzen.
Die Miniaturisierung führte aber auch zu höheren apparativen Ansprüche an eine UPLC Anlage (u.a. druckstabile Materialien und Bauweisen wie z.B. Hochdruck-Kapillarverbindungen, minimierte Volumina wie z.B. Totvolumina, Detektordurchflusszellen).
Welche Trennmechanismen gibt es?
In der HPLC und UPLC erfolgt die Trennung eines Substanzgemisches auf der Trennsäule, wobei die Trennung auf der unterschiedlichen Verteilung der Probesubstanzen zwischen der stationären Phase (Trennsäule) und der mobilen Phase (Eluent) beruht.
Einerseits sind diese Wechselwirkungen interaktive Wechselwirkungen der Probe mit der stationären Phase. Dann spricht man von Adsorptionschromatographie. Die adsorptiven Wechselwirkungen beruhen u.a. auf polaren bzw. unpolaren Eigenschaften von Probe und Säulenmaterial (van-der-Waals Wechselwirkungen) oder auf elektrischen Eigenschaften.
Typische Vertreter der Adsorptionschromatographie sind:
Normalphasenchromatographie (NP)
NP zeichnet sich dadurch aus, dass die stationären Phasen polare Oberflächeneigenschaften aufweisen und Eluenten mit unpolarem Charakter verwendet werden. Unter diesen Bedingungen können polare funktionelle Gruppen von Proben optimal mit dem Säulenmaterial wechselwirken und voneinander getrennt werden.
Hydrophile Interaktionschromatographie (HILIC)
In der HILIC sind die Analyten sehr polare Verbindungen, weshalb HILIC auch als Erweiterung der NP angesehen werden kann. Stationäre HILIC Phasen sind sehr polar und werden mit wässrigen mobilen Phasen verwendet. Gradientenmethoden starten dabei mit einem recht hohen organischen Anteil und enden mit einem höheren wässrigen Anteil.
Umkehrphasenchromatographie (RP)
Wie der Name schon erkennen lässt, haben die stationären Phasen im Gegensatz zur NP einen unpolaren Charakter, die mobilen Phasen einen eher polaren Charakter. Gradientenmethoden starten mit einem recht hohen wässrigen Anteil und enden mit einem höheren organischen Anteil. Die RP ist heutzutage die am häufigsten angewandte Trenntechnik in der Flüssigkeitschromatographie.
Ionen(austausch)chromatographie (IEX)
IEX kommt bei elektrisch geladenen Proben zum Einsatz und zeichnet sich durch die Wechselwirkung mit entgegengesetzt geladenen Oberflächenteilchen der stationären Phase aus. Mobile Phasen sind Pufferlösungen, deren Elutionskraft z.B. durch seine Zusammensetzung und seinen pH-Wert beeinflusst werden kann.
Chirale Chromatographie (Enantiomerentrennung, CLC)
Das Problem bei der Trennung von Enantiomeren besteht darin, dass sie fast identische physikalisch-chemische Eigenschaften besitzen und deswegen mit den klassischen adsorptiven NP oder RP Methodiken nicht aufzutrennen sind. In der CLC bedient man sich deshalb der Eigenschaft von enantiomeren Verbindungen, dass sie chirale Zentren aufweisen. Reagieren solche chiralen Zentren mit einem Gegenpart auf der stationären Phase oder einem passenden chiralen Eluentenzusatz zu «Diasteomeren», können diese chromatographisch aufgetrennt werden.
Hydrophobic Interaction Chromatography (HIC)
HIC bedeutet, dass durch Aussalzen einer relativ polaren Probe hydrophobe Wechselwirkungen zwischen Probe und stationärer Phase forciert werden. Diese Methodik findet hauptsächlich in der Proteinchromatographie ihre Anwendung, da ursprünglich polare Proteinmoleküle bei hoher Salzkonzentration ihre Hydrathülle verlieren und mit ihren unpolaren Molekülanteilen an einer mässig unpolaren stationären Phase wechselwirken können. Gradientenmethoden in der HIC starten mit einem recht hohen Salzanteil/Ionenstärke und enden mit sinkendem Salzgehalt/Ionenstärke.
Affinitätschromatographie (AC)
Auch die Methode der AC hat ihren Einsatzbereich bei der Auftrennung von Biomolekülen. Die Wechselwirkung zwischen Probe und stationärer Phase findet statt, indem man ganz spezifische Eigenschaften eines Biomoleküls ausnutzt und die stationäre Phase ganz gezielt auf diese spezifische Eigenschaft hin auswählt (z.B. Biomolekül <-> passender Antikörper auf der stationären Phase; Enzym <-> passender Inhibitor, Substrat oder Cofaktor auf der stationären Phase)
Neben der interaktiven Chromatographie gibt es aber auch die nicht interaktive Chromatographie. Dabei ist das Ziel, interaktive Wechselwirkungen der Probe mit der stationären Phase zu vermeiden. Ein typisches Beispiel für einen solchen Chromatographie-Typ ist die
Gelpermeationschromatographie (GPC / SEC)
Die GPC/SEC trennt ein Substanzgemisch nach der unterschiedlichen Grösse der einzelnen Probebestandteile auf. Die stationäre Phase in der GPC/SEC arbeitet also nicht nach dem Adsorptionsprinzip, sondern optimalerweise nur durch einen Siebeffekt der Poren des Säulenmaterials. So werden kleine Moleküle eines Substanzgemisches komplett in die Poren des GPC-Säulenmaterials eindringen können und später erst wieder eluiert werden, während mittelgrosse bzw. grosse Moleküle nur teilweise in die Poren eindringen und somit früher die Säule verlassen. Je nach Probeneigenschaft kann die GPC/SEC mit wässrigen oder organischen Eluenten betrieben werden.
Welche HPLC Detektoren gibt es?
Nach Verlassen der stationären Phase müssen die aufgetrennten Probekomponenten detektiert werden, um sie qualitativ und quantitativ auswerten zu können.
In der HPLC und UPLC stehen dazu eine Vielzahl von Detektoren zur Verfügung, die sich in selektive und unselektive bzw. universelle Detektoren aufteilen lassen.
Ein Detektor, dessen elektronisches Signal proportional zu einer bestimmten Eigenschaft einer Probe und/oder der mobilen Phase ist, gehört z.B. zu den unselektiven/universellen Detektoren. Er spricht praktisch auf jede Verbindung in der Probe an, die er prinzipiell detektieren kann.
Unselektive Typische Vertreter für unselektive/universelle Detektoren sind u.a.:
BrechungsindexdetektoR RI Detektor - REFRACTIVE INDEX DETECTORS
Brechungsindexdetektoren registrieren alle Substanzen, die eine Änderung des Brechungsindex der Lösung gegenüber dem reinen Lösungsmittel aufweisen. Ihre Empfindlichkeit ist daher davon abhängig, wie stark sich die Brechungsindices von reinem Lösungsmittel und gelöster Substanz unterscheiden. Aufgrund dieser generell eher kleinen Differenz ist die Detektorempfindlichkeit beispielsweise im Vergleich zu UV-Absorptionsdetektoren eher gering.
Brechungsindexdetektoren können für Substanzen eingesetzt werden, die im UV-Bereich nicht absorbieren und auch nicht mit Leitfähigkeitsdetektoren zu erfassen sind, beispielsweise bei der Analytik von Zuckern. In der Gelpermeationschromatographie von Polymeren werden RI-Detektoren aufgrund ihrer einfachen Bauart gerne verwendet, da der Brechungsindex von Polymeren bei unterschiedlicher Molmasse konstant ist, die Detektion daher quantitativ erfolgt.
Charged aerosol detector CAD Detektor
Der Charged Aerosol Detector (CAD) ist ein Detektor, der verwendet wird, um die Menge an Chemikalien in einer Probe zu messen, indem geladene Aerosolpartikel erzeugt werden, die mit einem Elektrometer nachgewiesen werden. Mit dem CAD können alle nichtflüchtigen und viele halbflüchtige Analyten gemessen werden, einschließlich, aber nicht beschränkt auf Antibiotika, Hilfsstoffe, Ionen, Lipide, Naturprodukte, Biokraftstoffe, Zucker und Tenside. Der CAD gehört wie andere Aerosoldetektoren (z. B. Verdunstungs-Lichtstreudetektoren (ELSD) zur Kategorie der destruktiven Allzweckdetektoren.
Verdunstungs-Lichtstreudetektor ELSD Detektor - Evaporative Light Scattering Detector
Einen Verdunstungs-Lichtstreudetektor benutzt man um Verbindungen, die kaum bis schwach im UV/VIS-Bereich detektiert werden können, nachzuweisen. Die Signalintensität des Detektors wird größtenteils von der molaren Masse des zu detektierenden Stoffes bestimmt; nicht etwa durch dessen chemische Zusammensetzung. Auch haben funktionelle Gruppen wenig Einfluss. Daher haben Stoffe mit ähnlichen molaren Massen auch ähnliche Signalstärken. Der Detektor eignet sich hervorragend für Gradientensysteme, da UV- bzw. Brechungsindex-Eigenschaften keinen Einfluss auf die Basislinie haben. Ein weiterer Vorteil besteht darin, dass die nachzuweisende Substanz keine Chromophore besitzen muss, wie es z. B. für Detektion mittels UV- oder Fluoreszenzdetektoren nötig ist.
Selektive Detektoren detektieren hingegen nur bestimmte Komponenten mit speziellen Eigenschaften (z.B. UV aktive Substanzen, fluoreszierende Verbindungen, ionische Proben). Typische Vertreter für selektive Detektoren sind u.a.:
UV/VIS Detektor UV/VIS Detektor - UV-Strahlung - visuelles Licht
Der UV/VIS-Detektor erfasst nur Analyten, die ausreichend UV-Strahlung bzw. sichtbares Licht (VIS) absorbieren. Bei kleinen Wellenlängen um 200 nm absorbieren viele Substanzen, meist aber auch der Eluent. Das Absorbptionsmaximum des Analyten soll längerwellig als die Eluentabsorption sein. Eingesetzt wird der UV/VIS Detektor zum Beispiel für (polyzyklische) Aromaten, konjugierte Doppelbindungssysteme, Doppel- und Mehrfachbindungen, Carbonylgruppen C=O
Dioden array Detektor DAD Detektor
Der DAD-Detektor ist ein UV/VIS Detektor welcher den gesamten Bereich von 190-800 nm erfasst. Das bringt grosse Flexibilität im Vergleich zum UV/VIS Detektor, da die Wellenlänge nicht bereits im Vorfeld bekannt sein muss.
Unterschied zwischen HPLC UV/VIS und HPLC DAD
Beim UV/VIS Detektor wird eine spezifische Wellenlänge (entweder mit Festwellenlänge oder variable einstellbar) monochromatisch erfasst. Hingegen beim DAD Detektor wird mit einer polychromatischen Lichtquelle angeregt. Auf dem Diodenarray wird zu jedem Zeitpunkt das ganze Spektrum erfasst. Durch die Flexibilität wird der DAD Detektor zum Beispiel in der Methodenentwicklung häufiger eingesetzt.
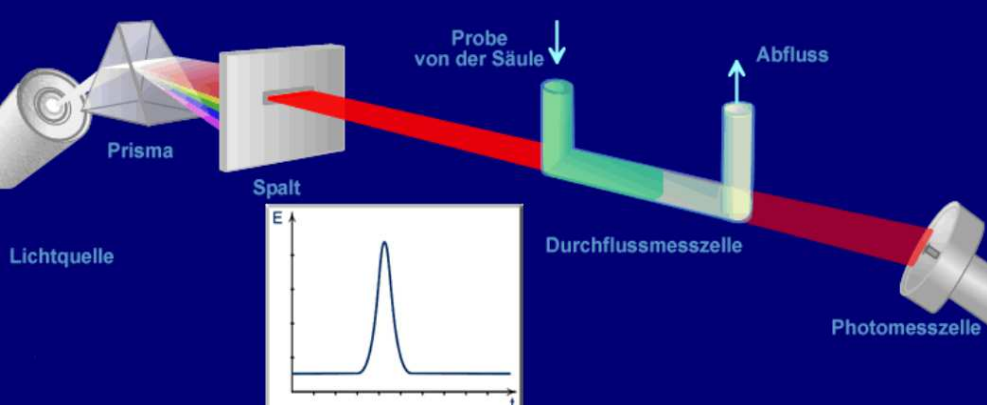
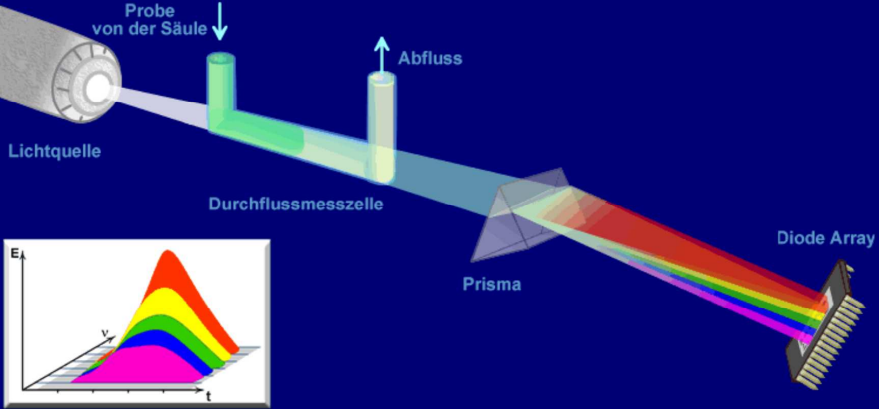
Fluoreszenz-Detektor FLD Detektor - fluorescent light detector
FLD ist ein sehr empfindlicher Detektor der 100-1000fach so empfindlich ist wie ein UV/VIS Detektor. Dieser Detektor ist abhängig von der chemischen Natur der Analyten. Er kann nur an fluoreszierenden Analyten wie z.B. polyzyklischen Aromaten angewendet werden. Deshalb kann er nicht universell eingesetzt werden.
Elektrochemischer Detektor ECD Detektor - electro chemical detector
Zu den elektrochemischen Detektoren zählen amperometrische und coulometrische Detektoren. Die elektrochemische Detektion basiert auf der Messung des Stromflusses zwischen zwei Elektroden während der Oxidation oder Reduktion von Analytmolekülen. Elektrochemische Detektoren sind für bestimmte Stoffklassen sehr viel nachweisstärker als UV/VIS-Detektoren und stellen für einige Substanzen die mit Abstand nachweisstärkste Detektionsmöglichkeit dar (z.B. die eurotransmitter aus der Gruppe der Catecholamine).
Leitfähigkeits Detektor HPLC CD - stimmt CD?? steht CD nicht fürCircular Dichroism
Die Detektion von Substanzen aufgrund von Leitfähigkeitsunterschieden des Gemisches „Analyt + Eluent“ ist besonders bei der Ionenanalytik von Bedeutung. Die Hauptschwierigkeit liegt in der hohen Grundleitfähigkeit der als mobile Phase eingesetzten Pufferlösungen. Deshalb werden vor dem Detektor Supressorsäulen eingebaut, in welchen die Ladung der Puffersalze neutralisiert wird.
Spezielle Detektoren sind so selektiv, dass sie nicht nur eine Probesubstanz detektieren, sondern auch in der Lage sind, bestimmte Strukturen oder Elemente mit einem hohen Grad an Zuverlässigkeit zu bestimmen. Zu diesen speziellen selektiven Detektoren gehören:
Massenspektrometrische Detektoren wie ESI Detektor - Elektrosprayionisation
Das ESI-Verfahren ist vor allem für polare Moleküle geeignet, insbesondere solche mit funktionellen Gruppen, die sich leicht protonieren oder deprotonieren lassen, was auf viele Moleküle bis hin zu Biopolymeren zutrifft. Dagegen sind unpolare Moleküle, wie unfunktionalisierte polyzyklische Aromaten der ESI nicht ohne vorherige Derivatisierung zugänglich.
Massenspektrometrische Detektoren wie APCI Detektor - atmospheric pressure chemical ionization
Auch für unpolare Moleküle geeignet ist das mit der ESI verwandte APCI-Verfahren. Auch hier wird das Eluat mittels einer Kapillare und eines Nebulizergases fein versprüht. Im Gegensatz zur ESI ist aber an die Kapillare keine Hochspannung angelegt, die Kapillare wird dagegen stark geheizt.
Fourier-Transform Infrarot spektrometrischer Detektor FTIR Detektor
Ein IR-Detektor ist im Prinzip ähnlich aufgebaut wie ein UV/VIS-Detektor, wobei
Infrarotstrahlung durch eine Küvette geschickt wird und das IR-Absorptionsspektrum
der Lösung „Eluent+Analyt“ aufgenommen wird. Da das Lösungsmittel auch IRAbsorptionsbanden hat, muss es sorgfältig ausgewählt werden, um die Analytbanden
nicht zu überdecken. Aufgrund dieser Limitierungen kann ein IR-Detektor oft nur
begrenzt eingesetzt werden. Die Nachweisstärke der IR-Detektoren ist eher gering
und etwa vergleichbar mit jener des Brechungsindexdetektors.
nuclear magnetic resonance Detektor NMR Detektor
Wegen der Möglichkeiten zur Strukturaufklärung ist die Kernmagnetische Resonanz
(nuclear magnetic resonance = NMR) prinzipiell eine hervorragende Detektionsmethode. NMR ist allerdings nicht sehr empfindlich, was technisch aufwendige
„stopped-flow“ Einrichtungen nötig macht, da eine NMR-Messung Minuten dauern
kann. Eine weitere Voraussetzung ist das Verwenden von deuterierten
Lösungsmitteln. Da NMR zudem eine teure Methode ist, wird sie in der Praxis selten
direkt mit LC gekoppelt.
Methodenentwicklung HPLC
Die HPLC und UPLC Methodenentwicklung verfolgt das Ziel, eine bestimmte Anzahl von Analyten in möglichst kurzer Zeit und bestmöglicher Auflösung zu trennen. Gleichzeitig sollen die Methoden reproduzierbar und robust sein, damit zu unterschiedlichen Zeiten, an verschiedenen Orten identische Ergebnisse erhalten werden können.
Eine zu entwickelnde chromatographische Methode besteht immer aus den voneinander abhängigen 3 Komponenten:
- Probe
- Stationäre Phase (Trennsäule)
- Mobile Phase (Eluent)
Diese 3 Komponenten des chromatographischen Systems müssen optimal miteinander kombiniert werden, um schlussendlich für ein vorliegendes Trennproblem die bestmögliche analytische Methode zu erhalten.
Ausgehend von dem zu lösenden Trennproblem und der Eigenschaften der zu analysierenden Probe gehören folgende prinzipielle Punkte zu einer Methodenentwicklung:
- Auswahl der Trenntechnik (RP, NP, HILIC, SEC, IEX,…)
- Auswahl der Säulendimension und LC (HPLC oder UPLC)
- Auswahl der stationären Phase (Kieselgel, RP18, chirale Säule, GPC-Säule….)
- Auswahl der mobilen Phase und (ggf.) Einstellung ihres pH-Wertes
- Durchführung von isokratischen oder Gradientenläufen
- Weitere Optimierung der Parameter, z.B. durch Variation
- der Temperatur
- des Puffer- oder Ionenpaarreagenzes
- der Flussgeschwindigkeit
- des Gradienten
- …
Wofür wird HPLC eingesetzt?
Die Flüssigchromatographie (LC) wird in vielen Bereichen sowohl analytisch zur Identifizierung und Quantifizierung von Substanzen oder der Bestimmung von Molekulargewichtsverteilungen eingesetzt, als auch präparativ zur Auftrennung bzw. Aufreinigung von Substanzgemischen.
Aufgrund der Vielzahl an stationären Phasen, Trennmechanismen und Detektoren reicht der Anwendungsbereich von kleinen anorganischen oder organischen Ionen, neutralen organischen Molekülen und Organometallkomplexen bis hin zu grossen Biomolekülen (z.B. Proteine).

